1. Incidence, predispozice a etiopatogeneze mastocytomu
Mastocytom (MCT) představuje jeden z nejčastějších nádorů kůže a jeho incidence dosahuje 16 – 21 % všech kutánních tumorů psů. Setkáváme se s ním častěji u starších zvířat (medián 8-9 let), ale vzniknout může v kterémkoliv věku.
U řady plemen se předpokládá genetická predispozice k rozvoji MCT. Častěji se s MCT setkáváme u brachycefalických plemen jako je boxer, bostonský teriér či mops, dále pak u různých plemen retrívrů, pitbullů a bullteriérů. U těchto plemen bývají MCT častěji benigní, ale ani agresivní subtypy nejsou výjimkou. Naproti tomu u šarpejů existuje jednoznačná predispozice pro rozvoj vysoce maligních MCT.
MCT vzniká z mastocytů (žírných buněk), které jsou součástí nespecifického imunitního systému organismu. Mastocyty regulují celou řadu obranných reakcí proti parazitárním a bakteriálním onemocněním. Jejich dysregulace je součástí patogeneze celé řady alergických onemocnění (atopická dermatitida, alergická rhinitida a bronchitida, astma, potravinová alergie, komplex eosinofilního granulomu). Jako jedna z možných příčin rozvoje nízce maligních MCT je diskutována chronická zánětlivá stimulace mastocytů u alergických onemocnění. V řadě studií je prokázána souvislost mezi atopickou dermatitidou a výskytem low-grade MCT. Naopak u vysoce maligních MCT jsou předpokládané jiné onkogenetické mechanismy, a to především na úrovni mutací signalizačních buněčných kaskád v čele s protoonkogenem receptoru tyrozinových kináz (c-KIT).
2. Klinická prezentace mastocytomu
Z hlediska klinické prezentace hraje klíčovou roli častá přítomnost paraneoplastického syndromu, která je typická pro maligní chování MCT. Rozvoj paraneoplastického syndromu souvisí s lokálním a systémovým uvolněním biologických mediátorů nádorových mastocytů. Mezi tyto mediátory patří histamin, heparin a sérové proteázy. Jejich lokální uvolnění vede k rozvoji zánětlivého edému charakterizovaného zarudnutím, otokem, bolestivostí a temperací. Této lokální reakci se rovněž přezdívá Darierův příznak.
Systémové působení biologických mediátorů vede u řady pacientů k chronické hyperhistaminemii, stimulaci gastrických H2-receptorů a hyperchlorhydrii s následným rozvojem gastroduodenálních erozí a ulcerací. Nedávné studie potvrdily, že incidence gastroduodenálních vředů dosahuje u pacientů s MCT až 80%. Pacienti tak mohou být prezentováni s anorexií, abdomenalgií, zvracením, melénou, anémií či hemoragickým šokem.
Vyplavení biologických mediátorů mastocytů může rovněž způsobit anafylaktický šok, kdy jsou pacienti prezentováni v kritickém zdravotním stavu s generalizovanou slabostí v laterální poloze a destabilizovaným kardiovaskulárním systémem (hypotenze, tachykardie, tachypnoe, prodloužené CRT). Epizody hypotenze mohou rovněž vést k anamnesticky opakovaným kolapsovitým stavům. Současná přítomnost MCT a paraneoplastického syndromu, by měla vždy vést k podezření na agresivní formu MCT.
Vlastní MCT vypadají morfologicky zcela rozdílně a mohou se podobat celé řadě jiných kutánních a subkutánních neoplazií. V zásadě rozlišujeme dva morfologické subtypy: kutánní a subkutánní MCT.
Subkutánní MCT vychází z podkoží a vlastní kůži většinou neinfiltruje. Subkutánní MCT je zcela běžně a mylně zaměňován za lipomy, případně jiné mezenchymální tumory, což má zásadní vliv na přežívání těchto pacientů. Klíčem ke správné diagnóze MCT je cytologické vyšetření (viz dále).
Častějším typem je tzv. kutánní MCT, který vychází z kůže a je rovněž často zaměňován za jiné typy kutánních neoplazií (histiocytom, lymfom, plazmocytom, epitheliální neoplazie). Kutánní MCT se může vyskytovat jak ve formě dobře diferencovaného MCT, který se jeví jako makroskopicky ohraničený, často alopetický kožní útvar, tak ve formě špatně diferencovaného MCT, který je často pro pacienta bolestivý, zarudlý, temperovaný, ulcerovaný a špatně ohraničený.
Mezi klinické příznaky malignity MCT patří rychlý růst, lokální zánět, špatné ohraničení od okolí, ulcerativní vzhled, tvorba dalších MCT v blízkém okolí (nejčastěji do 5cm, tzv. satelitní léze) a paraneoplastický syndrom.
Zvláštním subtypem kutánního MCT je primární multipní MCT, s kterým se setkáváme až u 20 % všech pacientů. Charakteristický je vznik multipních primárních MCT de novo. Tumorům těchto pacientů je mylně přisuzována vyšší biologická agresivita, protože multipní MCT jsou chybně považovány za metastázy. Mechanismus multipního výskytu primárních MCT je podmíněn genetickým defektem, který pacienta predisponuje k tvorbě nových a nových mMCT. Tento genetický defekt není spojen s vyšší četností metastáz do svodných mízních uzlin, ani dalších orgánů a neměl by být tudíž používán jako kritérium biologické agresivity tumoru. Důležité je používání relevantních prognostických faktorů (viz dále).
Vzácnou formou MCT je atypický MCT, což je MCT lokalizovaný jinde než v kůži a podkoží. Setkáváme se s intramuskulární formou, primárním postižením mediastina či dutiny břišní (viscerální MCT). Biologické chování atypických MCT je převážně agresivní.
3. CYTOLOGICKÁ DIAGNOSTIKA MASTOCYTOMU
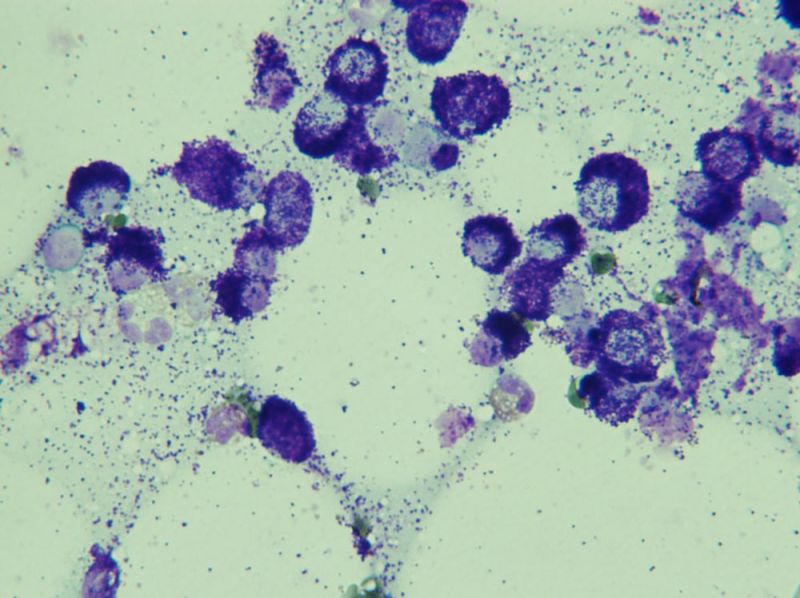
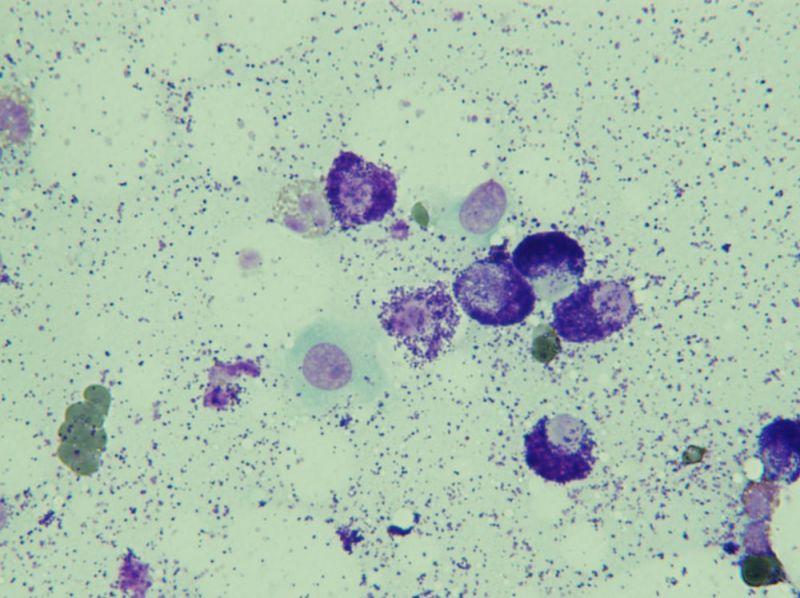
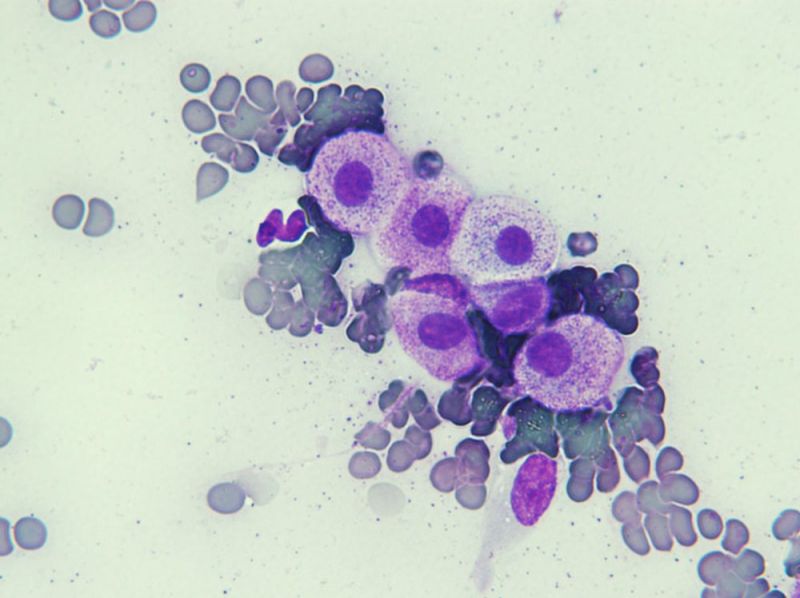
Spolehlivou diagnostickou metodou je tenkojehelná aspirace (FNAB) s následným cytologickým vyšetřením (viz obrazová příloha). Senzitivita a specifita cytologického vyšetření je přes 90 %. Cytologie není však vhodná pro stanovení prognózy MCT a jakékoliv stanovování cytologického gradu může být silně zavádějící a není doporučováno.
Dle studie Scarpa a kol. (2014) je možné uplatnit některá morfologická kritéria histopatologického gradingu dle Kiupela na cytologickou predikci biologického chování MCT. Cytologický systém dle Scarpa má značné limity a nenahrazuje tak histologický grading. Cytologickými kritérii korelujícími s histopatologickými nálezy jsou: multinukleace, karyomegálie, nukleární pleiomorfismus a méně spolehlivě stromální reakce a granulace mastocytů.Cytologický systém dle Scarpa umožňuje odlišit potenciální low-grade MCT od high-grade. Senzitivita pro záchyt high-grade MCT byla v této studii 85 % a specifita 97 % ve srovnání s histopatologií. Z pohledu diagnostiky může tento nový cytologický systém napomoci výběru pacientů pro detailnější diagnostický staging.
Predikce gradu MCT pomocí cytologického vyšetření by měla být prováděna jen zkušenými cytology s následnou verifikací pomocí histopatologie!
4. Staging mastocytomu
V připadě cytologické diagnózy MCT by mělo následovat rozhodnutí o dalším stagingu pacienta.
Kompletní staging zahrnuje cytologické vyšetření svodných mízních uzlin, USG abdomen, cytologii jater a sleziny a v případě lokalizace tumoru na hlavě/předních končetinách i RTG hrudníku, dále pak hematologii, biochemii a v případě cytopenií i biopsii kostní dřeně.
Kompletní staging je doporučován u pacientů vykazujících (dostačující je jedno kritérium):
- Paraneoplastický syndrom
- Špatně diferencovaný MCT (ulcerace, zarudnutí, neohraničitelný)
- Zvětšené svodné mízní uzliny
- Cytologický nález korelující s high-grade morfologií
- Rizikové plemeno (šarpej)
- Riziková anatomická lokalizace (hlava, mukokutánní přechody, ungulární lokalizace)
- Atypický MCT
U pacientů bez rysů maligního MCT, dostačuje základní staging skládající se z USG abdomen, hematologie a biochemie. Pokud tato vyšetření odhalí abnormality, které mohou korelovat s vyšším stage MCT, je vhodné provést kompletní staging.
Vyšetření mízních uzlin na přítomnost metastatických mastocytů je obtížné, protože až 25% všech mízních uzlin obsahuje zánětlivé mastocyty. Kritériem pro potvrzení metastatických mastocytů jsou buněčné atypie a shlukování mastocytů v clustery. V případě pochybností, je doporučován druhý názor specializovaného cytologa (tzv. second opinion). Výsledkem stagingu je takzvaný stage onemocnění (stádium rakoviny) korelující s prognózou a terapeutickým řešením.
STAGE mastocytomu
- Ohraničený lokální tumor bez postižení mízních uzlin
- Ohraničený lokální tumor s postižením svodných mízních uzlin
- Špatně diferencovaný lokální tumor, neohraničitelný nebo multipní kožní MCT
- Přítomnost distantních metastáz (játra, slezina, kostní dřeň)
Stage MCT určuje další terapeutické řešení pacienta.
Stage I a II je vhodné řešit pomocí chirurgického řešení (viz níže). U stage II je nutné odstranit chirurgicky i postižené mízní uzliny a optimálně doplnit chirurgickou excizi mízní uzliny o adjuvantní radioterapii.
U stage III se špatně diferencovaným lokálním tumorem je nutné kriticky zvážit možnosti radikální chirurgie, příp. doplnění terapie o před- či pooperativní radioterapii či případnou preoperativní neoadjuvantní chemoterapii či aplikaci TKI (viz dále).
U stage III s multipními MCT je vhodné pokusit se odlišit primární multipní MCT od metastatických MCT. Primární multipní MCT jsou morfologicky převážně dobře diferencované a klinicky lokálně benigní, narozdíl od metastatických multipních MCT, které jsou často morfologicky špatně diferencované, klinicky se prezentují maligně a při podrobném stagingu je častý nález metastáz do mízních uzlin a dalších orgánů.
Stage III primární multipní MCT jsou primárně kandidáty na chirurgické řešení, pokud je chirurgická excize technicky možná. Oproti tomu multipní metastatické MCT jsou často kandidáty jen na paliativní terapii (chemoterapie či TKI, viz dále). Stage III MCT jsou nejkomplikovanější skupinou z pohledu správné terapie, a měly by být jako takové referovány na konzultaci k specializovanému onkologovi.
Stage IV pacienti jsou kandidáty víceméně jen na paliativní terapii (chemoterapie či TKI, viz níže).
5. Chirurgie mastocytomu
V případě chirurgického řešení je vhodné u rizikových pacientů (kritéria jako u indikace kompletního stagingu) provedení radikální chirurgie s 3 cm volných laterálních okrajů a jedné intaktní fascie do hloubky. U pacientů bez rizikových faktorů je dostatečné provedení excize s 1-2 cm volných laterálních okrajů a jedné intaktní fascie do hloubky. Každý jednotlivý MCT je vhodné odeslat na histopatologické vyšetření. V případě excize mízní uzliny je doporučené odeslat na histopatologii i mízní uzlinu. Chirurgické řešení je terapeutickým řešením volby u všech lokalizovaných primárních tumorů a nemělo by být nahrazováno jinou terapií.
V případě komplikovaného provedení primární chirurgie či reoperace MCT doporučujeme získat druhý názor od specializovaného onkologického chirurga (tzv. second opinion).
6. Histopatologické vyšetření mastocytomu
Důležité je odeslat kompletní tumor kvůli možnosti posouzení volných laterálních a hlubokých okrajů. Volné okraje by po domluvě s histopatologem měly být označeny tak, aby mohly být později charakterizovány.
Posouzení volných okrajů rozhoduje o dostatečnosti lokální terapie. V případě, že je excize kompletní, není další lokální terapie nutná. Pokud jsou okraje excize hraniční a další prognostické faktory jsou nepříznivé, je vhodné provést doplňující lokální terapii (reoperace či radioterapie). Pokud jsou okraje excize nekompletní, je riziko lokální recidivy vysoké a je nutné provést doplňující lokální terapii (reoperace či radioterapie). V případě nejasností doporučujeme kontaktovat pro druhý názor specializovaného klinického onkologa (tzv. second opinion).
Dalším faktorem posuzovaným při histopatologickém vyšetření je grading MCT (stupeň malignity). Grading umožňuje odhadnout riziko horšího biologického chování, vzniku metastáz a lokální agresivity. Čím vyšší grade, tím horší prognóza a naopak.
Pro posouzení kutánních MCT doporučujeme provádět rutinně stanovení obou grading systémů a to grading dle Patnaika a Kiupela doplněný dále o stanovení mitotického indexu (počet na 10 hpf – high power field, zvětšení 100x). Patnaikův systém je tří stupňový (grade I-III), zatímco Kiupelův systém pouze dvou bodový (low- a high-grade). Grading dle Patnaika vychází z posouzení morfologie buněk, počtu mitóz, intracytoplazmatické granulace, četnosti nekróz a stromální zánětlivé reakce. Nevýhodou tohoto systému je částečná subjektivita a zařazení až 80% všech MCT do grade II, u nějž nelze spolehlivě předpovědět další biologické chování. Grading dle Kiupela používá k posuzování více objektivní kritéria: mitotický index s hranicí 7/10 hpf, multinukleace a bizarní jádra s hranicí 3/10 hpf a karyomegálii s hranicí 10% všech buněk. Nevýhodou tohoto systému je opomíjení některých histomorfologických rysů (viz Patnaik), které korelují s biologickým chováním MCT. Z tohoto důvodu je nejvíce užitečná kombinace obou systémů.
MCT high-grade dle Kiupela, grade III dle Patnaika nebo s vysokým mitotickým indexem (nad 5/10 hpf) vyžadují bez ohledu na lokální kontrolu MCT adjuvantní chemoterapii či TKI z důvodu vysokého rizika vzniku metastáz.
Grade II MCT dle Patnaika je vhodné doplnit o imunohistochemické vyšetření na expresi c-KIT a Ki-67 (viz níže). Grade I MCT dle Patnaika a low-grade dle Kiupela je vhodné doplnit o imunohistochemické vyšetření v případě přítomnosti dalších rizikových faktorů (viz výše u kompletního stagingu). V případě absence těchto faktorů není další diagnostika ani terapie v případě kompletní excize nutná.
Subkutánní MCT představují vlastní biologickou entitu a není na ně v tuto chvíli uplatňován blíže definovaný grading systém. Většina subkutánních MCT má v případě chirurgické excize příznivou prognózu, ale menší podskupina subkutánních MCT je rovněž spojena s agresivním biologickým chováním. Proto je doporučováno u subkutánních MCT posouzení mitotického indexu, buněčného pleiomorfismu a imunohistochemie na Ki-67.
V případě nepříznivých histomorfologických faktorů je u subkutánních MCT rovněž doporučitelná adjuvantní chemoterapie či TKI.
Atypické MCT jsou raritní a odpovídající grading systém v tuto chvíli chybí. Vhodné je posoudit histomorfologické faktory tak jako u subkutánních MCT. Přesto je adjuvantní chemoterapie či TKI doporučená ve většině případů atypických MCT. Vzhledem k raritnímu výskytu doporučujeme konzultaci se specializovaným onkologem.
7. Imunohistochemie
Imunohistochemie umožňuje posouzení prognostických faktorů nezávislých na histopatologickém gradingu, na nějž diagnosticky imunohistochemie navazuje. Provádění imunohistochemie bez odpovídajícího histopatologického gradingu je chybné a není doporučováno.
Při rutinní imunohistochemii se posuzuje proliferační faktor Ki-67, jehož aktivita se zvyšuje v aktivní fázi buněčného cyklu a souvisí s transkripcí ribozomální RNA. Exprese Ki-67 se nerovná mitotickému indexu, protože jeho aktivita není vázaná jen na mitózu, ale na celou aktivní fázi buněčného cyklu. Vyšetření Ki-67 nemůže být tedy nahrazeno posouzením mitotického indexu. Vysoká aktivita Ki-67 koreluje u MCT s vyšší biologickou agresivitou, vyšším rizikem metastáz a lokální recidivy.
Dále se rutinně posuzuje vzor exprese c-KIT receptoru. C-KIT je typ tyrozin-kinázového receptoru, který se je důležitý pro signalizační dráhy účastnící se proliferace, migrace a invazivního chování buněk. Fyziologicky se vyskytuje na povrchu buněk (typ barvení I), ale aberace v tomto receptoru mohou vést k jeho patologické distribuci uvnitř buněk (typ barvení II a III). Abnormality v expresi c-KIT korelují s horším biologickým chováním MCT. Především patologická distribuce typu III má negativní predikci na přežívání pacientů.
Grade II MCT dle Patnaika je vhodné doplnit o imunohistochemické vyšetření na expresi c-KIT a Ki-67. Grade I MCT dle Patnaika a low-grade dle Kiupela je vhodné doplnit o imunohistochemické vyšetření v případě přítomnosti dalších rizikových faktorů (viz výše u kompletního stagingu).
Z prognostických faktorů je možné dodělat i PCR na mutace protoonkogenu c-KIT receptoru. Přítomnost funkční mutace v exonu 8, 9 nebo 11 koreluje se zvýšenou aktivitou tyrozin kinázového receptoru a s horším biologickým chováním MCT.
Přítomnost mutace koreluje i s lepší odpovědí MCT na terapii TKI (viz níže).
Stanovení mutace je smysluplné pouze tehdy, pokud laboratoř stanoví všechny tři subtypy mutace. Mutace c-KIT receptoru nebyly dosud prokázány u subkutánních MCT, a proto u této skupiny není tato diagnostická metoda doporučitelná.
8. Adjuvantní terapie mastocytomu
8.1. Radioterapie mastocytomu
Je vhodná pro pacienty s vysokým rizikem lokální recidivy (nekompletní či hraniční chirurgické okraje), kdy pro lokální kontrolu není další operace technicky možná (např. MCT v oblasti hlavy) nebo pouze za cenu agresivní chirurgie (např. amputace končetiny). Radioterapie slouží i pro lokální kontrolu pacientů s metastázami do mízních uzlin pro asanaci okolí excidované mízní uzliny.
Radioterapie není indikována pro terapii makroskopických tumorů z důvodu rizika masivní degranulace neoplastických mastocytů po ozáření. Pro posouzení indikace pacienta k radioterapii doporučujeme kontaktovat specializované radioonkologické pracoviště.
8.2 Chemoterapie mastocytomu
Adjuvantní chemoterapie je doporučována u pacientů s vyšším rizikem vzniku metastáz, s diagnostikovanými metastázemi či s neoperabilními biologicky agresivními MCT (klinická kritéria malignity – viz výše).
Za pacienty s vyšším rizikem metastáz jsou považováni:
- High-grade MCT dle Kiupela
- MCT grade III dle Patnaika
- MCT s mitotickým indexem vyšším než 5/10hpf
- MCT grade II dle Patnaika či low-grade dle Kiupela s nepříznivými molekulárními markery (vysoká hodnota Ki-67, abnormální vzor exprese c-KIT typu III, mutace protoonkogenu c-KIT)
- MCT s postižením mízních uzlin
- Atypické MCT (viscerální, mediastinum, intramuskulární)
- MCT s klinickými kritérii malignity (ulcerace, neohraničitelný růst, zánětlivý edém)
Z kurativního hlediska je cílem chemoterapie snížit incidenci metastáz a oddálit dobu do jejich případného vzniku.
U pacientů s neoperabilními biologicky agresivními MCT či prokázanými metastázemi je chemoterapie pouze paliativní léčbou, jejímž cílem je oddálit další progresi onemocnění a zlepšit kvalitu života pacienta s MCT.
Jako chemoterapie se nejčastěji používá monoterapie vinblastinem, lomustinem či chlorambucilem nebo kombinace vinblastinu a lomustinu. Pro vhodnou indikaci a výběr chemoterapie doporučujeme kontaktovat veterinárního klinického onkologa. Chemoterapie nenahrazuje primární chirurgické řešení pro eliminaci operabilního tumoru. Chemoterapie by neměla být rovněž používána jako alternativa za radioterapii pro zvýšení lokální kontroly MCT v případech, kdy další chirurgie není možná. Pacienty na chemoterapii je vhodné monitorovat z hlediska potenciálních nežádoucích účinků (hematologie a biochemie před každou aplikací plus hematologie 7-10dní po první aplikaci cytostatika). Efektivitu paliativní chemoterapie je doporučené posoudit po 2-3.aplikaci, respektive po 6-8týdnech od zahájení chemoterapie. Posuzují se morfologická kritéria (vzhled a velikost tumoru či metastáz) a klinický stav pacienta (kvalita života, ústup paraneoplastického syndromu).
8.3 Inhibitory tyrozin kinázových receptorů (TKI) pro terapii mastocytomu
Pro použití ve veterinární medicíně jsou registrovány dva medikamenty: Masivet (masitinib) a Palladia (toceranib). Oba dva preparáty využívají reverzibilní inhibice tyrozin kinázového receptoru c-KIT, který hraje důležitou roli v onkogenezi, proliferaci a metastatickém potenciálu MCT.
Oba dva preparáty mají oficiální registraci pro neoperabilní a recidivující high-grade MCT. Masitinib má oficiální registraci dokonce jen pro výše charakterizované MCT s prokázanou mutací protoonkogenu c-KIT.
Ze studií vyplývá, že odpověď MCT s mutací c-KIT koreluje s vyšší a efektivnější reakcí na terapii TKI. Přesto oba dva TKI a především pak toceranib blokují i další typy buněčných receptorů a jsou schopni ovlivnit biologickou aktivitu MCT i dalšími způsoby.
TKI by neměly být používány jako primární alternativa k chirurgii, adjuvantní radioterapii či chemoterapii. TKI je doporučeno používat jen u pacientů, u nichž výše uvedená standardní terapie selhala, není dostupná či proveditelná (např. obavy majitelů či jiné racionální důvody k odmítnutí chemoterapie).
Použití TKI může vyvolávat celou řadu nežádoucích účinků (myelosuprese, gastrointestinální nežádoucí účinky, hepatopatie, nefropatie, IMHA), proto je zásadně důležitý monitoring laboratorních hodnot (hematologie, biochemie) a v případě masitinibu i vyšetření moči dle schématu ve schváleném příbalovém letáku. Zanedbání monitoringu může vést k závažnému poškození pacienta.
Před použitím TKI doporučujeme kontaktovat specializovaného veterinárního klinického onkologa.
9. Podpůrná terapie
Cílem veškeré onkologické terapie je zlepšení kvality života pacienta. MCT je typický rozvojem paraneoplastického syndromu, a proto je jedním z cílů terapie i potlačení jeho působení na pacienta.
Proti degranulaci tumoru a stabilizaci nádorového prostředí jsou používány H1-antagonisté (např. diphenhydramin, chlorpheniramin) a kortikosteroidy. Použití kortikosteroidů by mělo být limitováno u pacientů s možnou indikací pro chemoterapii na co nejkratší nezbytnou dobu. Dlouhodobé použití kortikosteroidů zvyšuje riziko rozvoje rezistence na cytostatika a nižší efektivitu chemoterapie.
Proti nežádoucímu působení hyperhistaminémie na alimentární trakt jsou používány H2-antagonisté (famotidin, ranitidin), případně jejich kombinace s inhibitory protonové pumpy (omeprazol, pantoprazol).
U pacientů s vysokým rizikem gastroduodenálních ulcerací je terapie doplňována o sukralfát či misoprostol.
10. Klíčové informace (Take home message)
- MCT může vypadat klinicky jakkoliv, a proto je cytologické vyšetření indikované pro potvrzení diagnózy u všech kožních a podkožních tumorů.
- Řada pacientů není prezentována kvůli vlastnímu MCT, ale kvůli rozvoji častého paraneoplastického syndromu. Paraneoplastický syndrom je rovněž nejčastější příčinou morbidity a mortality pacientů s MCT.
- Diagnózu MCT je možné učinit spolehlivě pomocí cytologického vyšetření.
- Prognóza se odvíjí od celé řady faktorů: klinických známek malignity, paraneoplastického syndromu, histopatologického gradu, molekulárních prognostických markerů a stádia (stage) onemocnění. Ne každý MCT je maligní, a proto ne každý MCT vyžaduje intenzivní a často drastickou terapii. Naproti tomu zanedbání terapie u maligních MCT může vést k dramatickému konci.
- Nejdůležitějším prognostickým faktorem je kombinovaný histopatologický grade dle Kiupela a Patnaika.
- Nejvhodnější primární terapií je chirurgická excize.
- Radioterapie je určená pouze pro pacienty s nedostatečnou lokální kontrolou po chirurgii, kdy další chirurgické řešení není možné nebo vhodné.
- Chemoterapie je určená pro pacienty s vyšším rizikem vzniku metastáz, s diagnostikovanými metastázemi či s neoperabilními biologicky agresivními MCT.
- TKI by neměly být používány jako primární alternativa k chirurgii, adjuvantní radioterapii či chemoterapii. TKI je doporučeno používat u pacientů, u nichž výše uvedená standardní terapie selhala, není dostupná či proveditelná.
- Cestou k úspěšné individuální terapii pacienta s MCT je adekvátně rozsáhlá diagnostika (staging + grading). Snaha o zredukování diagnostiky zvyšuje riziko nevhodně zvolené terapie, morbidity a mortality pacienta a ve svém důsledku frustraci z terapie pacientů s MCT.

MVDr. Ondřej Škor, res. ECVIM-CA
e-mail: ondrejskor.oncology@gmail.com